1. 실험 제목: 알코올의 정량 분석
2. 실험 목적: 산화 크로뮴(VI)(CrO₃)이 알코올에 의해서 산화 크로뮴(III)(Cr₂O₃)으로 환원되는 반응을 가시광선 분광기를 이용하여 측정하고 알코올의 농도를 알아낸다.
시약 및 실험기구: 산화크로뮴(VI)(10%(w/w)), 에탄올 7.5%, 12%, 20%, 27%(v/v), 미지 시료(시중 판매 소주)
| 시약명 | 화학식 | 몰질량(g/mol) | 녹는점(℃) | 끓는점(℃) | 밀도(g/mL) |
| 에탄올 | C₂H5OH | 46.069 | -114.14 | 78.24 | 0.7893 |
| 산화 크로뮴(VI) | CrO₃ | 99.993 | 197 | 250 | 2.7 |
3.실험도구: 큐벳 8개, 삼각 플라스크 6개, 50mL 비커 7개, 마이크로 피펫, 분광기, 노트북, 눈금 실린더
4.이론
1) 정량 분석법: 물질을 구성하는 양적 관계를 명확하게 하는 분석법의 총칭이다. 정성분석과 정량 분석으로 나뉘고 정량 분석은 크게 기기 분석과 화학 분석으로 다시 나뉜다. 정성분석은 미지 시료에 무엇이 들어 있는지 확인하는 분석방법이다. 일반적으로 먼저 정성분석을 하여 그 성분을 알아낸 뒤에 정량 분석한다. 화학적·물리적 또는 양쪽을 병용한 방법이 주로 사용된다.
1-1) 기기 분석: 물리 분석이라고도 하며 기계 및 기구를 사용해서 수행하는 분석방법이다. 분광 분석법, 전기분석법, 분리법 등이 기기 분석에 속한다.
1-2) 화학 분석: 화학 반응을 이용해서 성분의 양을 결정하는 방법이다. 종류로는 부피 분석과 무게 분석이 있다.
부피 분석: 농도를 아는 표준 용액을 뷰렛에 넣고 시료 용액에 조금씩 떨어뜨려 반응이 끝났을 때의 표준 용액의 소비량으로 시료의 농도를 결정하는 방법이다.
무게 분석: 어떤 물질을 구성하고 있는 성분 중에서 목적하는 성분을 분리시키고 이들의 무게를 측정함으로써 목적하는 성분의 양을 결정하는 방법이다.
2) 분광분석법
화합물이 흡수 또는 방출하는 전자기 복사선(빛)의 파장에 따른 흡수 또는 방출의 정도를 측정하여 화합물의 농도를 알아내는 방법이다. 모든 화합물은 화학결합 상태나 구조적인 특성에 따라 독특한 구조를 가지고 있기 때문에 가시광선이나 자외선을 흡수하는 성질이 모두 다르다. 분자는 전자의 에너지 준위들 사이의 에너지 차이가 광자의 에너지(hv)와 같은 특정 에너지의 경우에만 빛을 흡수한다. 따라서 빛의 파장을 변화시키면서 분자에 의해서 흡수되는 정도를 나타내는 흡수 스펙트럼은 분자의 종류를 알아내기 위한 방법으로도 많이 이용되지만 분자가 일정한 파장의 빛을 흡수하는 정도를 측정해서 용액 속에 포함되어 있는 화합물의 농도를 알아내는 목적으로 활용되기도 한다.
3) 투광도, 흡광도
투광도는 광원에서 빛을 비추면 이를 파장 선택기에서 파장을 통해 빛을 선별하고 시료에 빛을 비춰주는데 이때 빛의 세기를 P0라고 하고 시료에 빛을 쪼여준 뒤 방출되는 세기를 P라고 하였을 때 P/P0의 비로 정의한다.
흡광도 측정법은 물질이 좁은 차장 범위의 빛을 흡수하는 정도를 측정하는 방법인데 흡광도(A)는 단색광이 어떤 물질의 용액을 투과할 때 투과광의 강도 I에 대한 입사광에 강도 I0의 비율의 상용대수를 일컫는다. 물질의 용액에 빛을 통할 때 흡광도는 그 빛의 파장에 따라 다르다. 따라서 파장을 조금씩 변화 시킨 빛에 대하여 흡광도를 측정하고 이들 흡광도 파장의 관계를 나타내는 곡선을 그리면 흡수 스펙트럼이 얻어진다. 흡수 스펙트럼은 그 물질의 화학구조에 의하여 정해지므로 흡수의 극대 파장에서의 일정 농도의 용액의 흡광도를 측정하여 정량을 한다.
4) 베르-람베르트 법칙
베르 법칙
a는 흡수계수라 부르며 흡수물질의 농도 c에 비례한다는 법칙이다. 이때 a=kc라는 관계식을 따른다. 베르 법칙은 회합 등에 의한 분자의 상태변화가 거의 없는 묽은 용액이나 기체에서 잘 성립된다. 또 이 법칙은 물질의 농도를 결정할 수가 있기 때문에 비색분석의 기본원리로 되어있다.
2. 람베르트 법칙
입사광의 세기를 I₀, 투과광의 세기를 I라 하면 I₀/I의 로그값은 흡수층의 두께 l에 비례하는데 이것을 람베르트 법칙이라고 한다. 이 값이 클수록 물질 층은 빛을 많이 흡수한 것이 되어 색이 진하게 보이다. (가시광선뿐만 아니라 적외선, 자외선 등 모든 전자기파에 적용된다.)

3. 베르-람베르트 법칙
흡광도는 투과 거리에 해당하는 시료 용기의 두께(l), 그리고 시료의 농도(c)에 비례하며 비례 계수를 a로 하면 A=a*l*c의 관계식을 따른다. a를 흡광 꼐수라 하고 특히 l을 cm, c를 mol/L 단위로 하였을 때의 비례 계수를 몰흡광 계수(ε)라고 한다.
따라서 시료의 흡광 계수와 투과 거리를 알고 있는 경우에는 시료 용액의 흡광도를 측정하면 용액 속에 빛을 흡수하는 물질의 농도를 알 수 있다. 흡광 계수란 각 화합물이 가지고 있는 고유의 성질인데 입사광의 진동수와 분자의 단면적과 연관이 있다. 빛을 받는 단면적이 크면 더욱 흡광이 잘 일어나고 그 단면적은 분자의 종류에 따라 달라진다. 일반적으로 분광기에서는 %투광도 T(%)=(I/I0)*100를 읽게 되어 있다. 투광도와 흡광도는 결국 다음과 같은 관계를 갖는다.
A=-logT=2-log%T
5) 측정 파장의 선택
시료의 흡광도를 이용하는 분광 분석에서는 원하는 화합물만이 선택적으로 흡수하는 빛의 파장을 이용해야 한다. 따라서 이 실험에서는 알코올이나 산화 크로뮴(VI)은 흡수하지 않고 환원된 크로뮴(III)만이 흡수하는 빛의 파장을 선택해야 한다. 그림 1을 보면 산화 크로뮴(VI) 용액은 파장이 550nm보다 짧은 빛을 많이 흡수하지만, 파장이 600nm보다 긴 파장은 흡수하지 않는다는 사실을 알 수 있다. 이와는 달리 알코올과 반응하여 환원된 산화 크로뮴(III)의 경우에는 600nm 부근의 빛을 상당히 잘 흡수하고, 파장이 길어지면 흡광도는 감소한다. 따라서 파장이 600nm인 빛을 사용하면 알코올에 의해서 환원된 청록색의 산화 크로뮴(III)만에 의한 흡광도를 측정할 수 있다.
6) 베르 법칙 적용의 한계
흡수 화학종의 농도가 일정한 경우, 흡광도 A와 광로 b 사이의 직선관계는 특별한 경우를 제외하고 항상 성립한다. 이와는 반대로 b가 일정할 때 측정한 흡광도와 농도가 항상 직선관계를 유지하는 것이 아니다. 베르 법칙은 농도가 묽은 경우에서만 성립하고, 농도가 진해져서(0.01M보다 진한 경우) 흡수 화학종 사이의 평균 거리가 가까워져 서로의 전자 분포 상태에 영향을 주게 되면 일정한 파장의 빛에 대한 흡수가 감소한다. 화학종 간의 상호 작용은 농도에 따라 다르고, 따라서 이 현상은 흡광도와 농도 사이의 직선관계에 편차를 주게 된다. 그러므로 측정 농도에 한계가 있다. 단일 파장의 빛에 적용해야 하며 화학 평형에 관여하지 않아야 한다.
7) 산화 크로뮴(VI)에 의한 에탄올의 산화 반응
에탄올과 같은 알코올은 밝은 주황색의 산화 크로뮴(VI)에 의해서 쉽게 산화되어서 카복실산이 되고 환원 상태의 산화 크로뮴(III)이 생성된다. 탁한 청록색을 내는 환원 상태의 산화 크로뮴(III)이 혼합된 용액의 흡광도는 베르 법칙을 따르기 때문에 용액 속에 들어 있는 산화 크로뮴(III)의 농도는 흡광도를 측정해서 알아낼 수 있으며 산화 크로뮴(III)의 양으로부터 용액에 들어 있던 알코올의 농도를 계산할 수 있다.
3CH₃CH₂OH + 4CrO₃ -> 3CH₃COOH + 3H₂O +2Cr₂O₃
8) 알코올
N차 알코올은 실험에서 쓰는 알코올과 같이 0, 1, 2, 3차 알코올로 나뉜다. 실험에서 쓰는 에탄올은 1차에 해당한다. N가 알코올은 탄소 원자에 결합하는 하이드록시기(-OH)의 수에 따라 1, 2, 3가로 나눈다. 에탄올은 1가 알코올이다. 1차 알코올은 알데하이드를 거쳐서 카복실산으로 산화된다.

2차 알코올은 케톤으로 산화된다. 3차 알코올은 탄소 주변에 H가 없어 산화되지 않는다.

5. 실험방법
1) 측정 파장의 선택과 표준 곡선 만들기
1. 산화 크로뮴(VI)(10%(w/w)) 1mL를 비커에 넣고 증류수 9mL를 넣어 묽힌 후 큐벳에 넣어 시료의 흡수 스펙트럼을 관찰하여 빛을 흡수하지 않는 파장대를 확인한다.
2. 4개의 삼각 플라스크에 산화크로뮴(VI) 용액을 10mL씩 넣고 에탄올 표준 용액 7.5%(v/v), 12%(v/v), 20%(v/v), 27%(v/v)를 각각 1mL씩 넣는다.
3. 포일로 덮은 후에, 에탄올을 넣은 삼각 플라스크를 5분간 잘 흔들어 준다.
4. 3의 용액들 각각 1mL씩 새 비커에 옮겨 담고 증류수 9mL를 넣어 묽힌 뒤, 큐벳으로 옮겨 흡수 스펙트럼을 관찰하고 네 시료의 스펙트럼을 비교하여 환원된 산화크로뮴(III)에서만 흡수되는 파장을 찾는다.
5. 선택한 파장으로 네 시료의 흡광도를 측정한다.
6. 0%, 7.5%, 12%, 20%, 27% 에탄올 표준 용액이 들어간 시료의 흡광도로 환원된 산화 크로뮴(III)의 표준 곡선을 엑셀을 사용하여 작성한다.
2) 미지 에탄올의 정량
1. 삼각 플라스크에 10mL의 산화 크로뮴(VI)을 넣는다.
2. 미지 농도의 알코올 용액 1mL를 취해서 넣고 5분간 흔들어 준다.
3. 피펫으로 2번 용액 1mL를 취하여 깨끗한 비커에 넣고 증류수 9mL를 넣어 묽힌 뒤 흡광도를 측정한다.
6. 관찰
 |
 |
 |
| 산화크로뮴(VI)가 밝은 주황색을 띄다가 에탄올과 반응해 탁한 청록색을 띄는 산화크로뮴(III)을 생성하였다. 그리고 흡광도 측정을 위해 산화크로뮴(III)이 있는 용액의 농도를 묽혔다. | ||
결과
측정 파장의 선택
산화 크로뮴(VI)과 알코올이 반응하여 산화 크로뮴(III)이 생성되면 600nm에서의 흡광도를 보인다.
산화 크로뮴(VI)(CrO₃)의 600nm의 빛에서 A=0에 수렴함을 확인하였다.
| 0% | 7.5% |
 |
 |
| 12% | 20% |
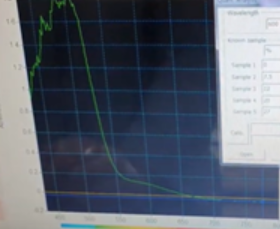 |
 |

| 27% | 미지 시료 |
 |
 |
2. 다양한 농도의 에탄올 흡광도 표준 곡선 만들기(a구하기)
에탄올의 농도를 x축, 흡광도를 y축으로 해서 농도와 흡광도의 관계를 그래프와 식으로 나타낸다.
| 에탄올 수용액의 퍼센트 농도 | 흡광도(a.u.) |
| 0% | -0.007 |
| 7.5% | 0.111 |
| 12% | 0.190 |
| 20% | 0.269 |
| 27% | 0.309 |
3. 에탄올의 정량
미지 시료의 흡광도를 분광기로 구하고, 베르 법칙으로 미지 시료의 알코올 농도를 구한다.
| 에탄올 수용액 | 흡광도(a.u.) | 농도(%) |
| 미지 시료 | 0.268 | 21.2% |
4. 오차율
실제 미지 시료의 알코올 농도는 17.5%이다.
오차율은 21.0%이다.
7. 토의
1) 오차 원인 분석 및 결과
우리는 베르-람베르트 법칙을 이용하여 흡광도와 농도 사이의 관계를 일차함수로 근사시켜 이 관계를 통해 미지 시료의 농도를 구하였다. 엑셀을 통해 작성한 표준 곡선을 보게 되면 우리가 작성한 추세선과 실제 측정한 흡광도의 그래프는 7.5% 정도까지 낮은 농도에서는 거의 비슷하지만 그 이후에는 차이가 크게 발생한다. 그래서 이로 인해 농도가 높은 에탄올 수용액을 넣어주었을 때는 오차가 발생하게 되는 것이다.
2) 이론이 어느 부분에서 적용되었는가?
베르-람베르트 법칙을 이번 실험에 적용하면서 흡광계수는 물질의 특성이므로 일정하고 같은 큐벳을 사용하니 큐벳의 두께도 일정하므로 흡광도의 변화 요인을 넣어준 에탄올 수용액의 농도로 인해 반응 후 묽힌 용액 내 산화크로뮴(III)의 농도로 단정하고 실험을 진행함으로써 미지 시료의 에탄올 농도를 측정해볼 수 있었다. 그리고 산화 크로뮴(III)의 농도를 측정하여야 했기에 산화 크로뮴(VI)이 흡수하는 빛의 파장을 피해서 파장을 선택함으로써 산화크로뮴(III)의 농도를 측정할 수 있었다.
3) 알코올과 산화 크로뮴의 반응식을 써보고 산화수를 이용하여 산화-환원을 설명해 보자.

에탄올의 C의 산화수는 -2였으나 반응후 아세트산의 C를 보면 탄소의 산화수는 0이 되면서 산화수가 2 증가하여 산화된 것을 알 수 있다. 그리고 산화크로뮴(VI)의 Cr은 반응 전 산화수가 +6이었으나 반응 후 산화크로뮴(III)의 Cr의 산화수는 +3으로 3이 감소하여 환원된 것을 알 수 있다. 반응식 전체에서는 에탄올의 탄소가 전자를 12개를 잃고 산화크로뮴(III)이 전자를 12개를 얻어 생성된 것으로 확인할 수 있다.
4) 만약 600nm에서 산화 크로뮴(VI)의 흡광도가 무시할 수 없을 정도라면 실험 결과에 어떤 영향을 주겠는가?
흡광도가 거의 0이 아니라면 중첩이 일어나고 알코올의 정량 분석에 추가로 크로뮴산의 농도가 혼합될 수 있고 환원된 크로뮴3와 알코올의 산화 반응에서 온전히 반응이 이루어지지 않으며 그 양과 농도도 정량이 나오지 않을 것이다. 흡광도가 좀 더 커지게 되고 투광도값 역시 달라진다.
5) 표준 곡선을 이용하여 미지 시료의 농도를 구하는 방법을 Beer-Lambert 법칙을 적용하여 설명해 보자.
흡광도의 값은 Beer-Lambert에 따라 흡광계수*큐벳의 두께*시료의 농도로 표현이 되는데 에탄올 수용액의 퍼센트 농도를 달리하면서 흡광도를 측정한다면 이들 사이의 관계를 같은 물질이므로 흡광계수는 같고 큐벳의 두께는 일정하므로 시료의 농도를 변수로 갖으며 변하는 일차함수로 근사시켜 생각해 볼 수 있다. 따라서 x축을 에탄올 수용액의 농도, y축을 흡광도 값으로 설정하고 추세선을 그려본다면 미지 시료의 흡광도 값을 측정하고 추세선을 통해 얻은 함수의 y값에 대입해 봄으로써 이에 대응되는 미지 시료의 에탄올 농도값을 얻을 수 있다.
6) 알코올과 반응시킨 산화 크로뮴을 묽히지 않고 흡광도를 측정한다면 어떻게 될지 생각해 보자.
반응시킨 용액을 묽히지 않고 흡광도를 측정할 경우 농도가 진해지면서 산화 크로뮴 사이의 평균 거리가 가까워져 서로의 전자 분포 상태에 영향을 주게 되고 일정한 파장의 빛에 대한 흡수가 감소하게 된다. 흡수가 감소하니 투과되는 빛의 세기가 제대로 된 측정보다 클 것이고 흡광도는 –log(I/I0)인데 I의 값이 I/I0<1이라 로그값은 음의 값인데 –부호를 붙여 양으로 값으로 표현하는데 I가 커질수록 흡광도의 값이 작게 측정될 것이다.
'화학1 및 실험' 카테고리의 다른 글
| #7. 재결정과 혼합물 (0) | 2024.06.20 |
|---|---|
| #6. 비타민C 분석 (0) | 2024.06.20 |
| #3. 크로마토그래피 (0) | 2024.05.09 |
| #2. 중화열 측정 (0) | 2024.05.09 |
| #1. 몰질량 측정 (0) | 2024.05.09 |